


【7月9-11日 医械线上培训】 GB/T42061/ISO13485:2016医疗器械质量管理体系内审员培训
课程概述
医疗器械质量管理体系法规是在ISO13485标准的基础上,进一步提出了《医疗器械生产质量管理规范的要求》,并通过各《现场检查指导原则附录》,强化了医疗器械GMP的具体要求,上述三者是履行《医疗器械监督管理条例》和《医疗器械生产监督管理办法》的核心文件。
本次课程以GB/T42061/ISO13485为基础,依据医疗器械GMP规范要求讲述质量管理体系的核心要素,结合具体审核案例解读医疗器械审核的流程、方法、检查内容、不符合项确定以及改进建议,并通过不符合案例的分析,帮助内审员快速提升审核能力和内审文件编写水平,实现“零”基础可操作的实务培训目的。
线上参会权益 1、简单方便——一个账号、一间会议室、一个投屏(LED、电视观看最佳); 课程特色 1.本次授课包含标准与医疗器械GMP双重内容,并结合大量实际案例分析; 2.本次课程依从标准,按照GMP审核要求,展开实务的充分讲解,结合不符合案例分析,飞检案例等; 3.参与课程讨论,通过与老师交流和讨论,解决实际工作问题 讲师介绍 01 李静芝:国家级质量体系审核员 课程时间安排 7月9日 9:00-12:00 13:30-16:30 医疗器械质量管理体系审核基础知识 一、内审员的能力和素质要求 课程说明 参考国家质量管理体系审核员要求,结合医疗器械监管法规,明确内审员应具备的能力与素质。 二、基于ISO13485过程管理的GMP审核模块质量管理要点解读(上) 1.领导作用及管理活动 课程说明 基于 ISO13485 与医疗器械 生产质量管理规范及相关附 录的要求,结合审核实际经 验,讲解相关模块的法规要 求及执行要点 。 三、基于ISO13485过程管理的GMP审核模块质量管理要点解读(下) 7.质量风险管理 课程说明 基于ISO13485与医疗器械生产质量管理规范及相关附录的要求,结合审核实际经验,讲解相关模块的法规要求及执行要点 7月10日 9:00-12:00 13:30-16:30 医疗器械质量管理体系审核实操案例 一、审核的组织与审核计划的编制 课程说明 结合记录模版,实例讲解审核操作实务与注意事项 二、ISO13485审核全表设计内容解析 课程说明 依据ISO13485标准要求,以实际审核表为样例,逐项讲解各条款的具体审核内容 三、医疗器械GMP审核全表设计内容解析 课程说明 依据医疗器械生产质量管理规范及相关附录要求,以实际审核表为样例,逐项讲解各条款的具体审核内容 四、审核记录的编写 课程说明 以实际审核记录为例,强化审核记录的编写要求与要点 7月11日 9:00-12:00 13:30-17:30 医疗器械质量管理体系审核不符合项实例分析 一、审核的不符合整改与审核报告编制 课程说明 以实例模版,明确不符合项整改的要求及审核报告编写的要点 二、首次注册内审不符合项案例分析 课程说明 对基于注册现场核查指南、生产许可现场检查要求的开展的注册现场核查质量管理体系预审核,发现的不符合项实例进行分析,明确不符合项的内容、改进的建议,可能触发的延伸检查分析 三、上市后生产内审不符合项分析 课程说明 基于医疗器械GMP法规条款项目,结合飞检发现的不符合案例整理,分析具体的不符合要求、改进的建议,可能触发的延伸检查分析 四、答疑环节 五、统一考试 学员获益 掌握GB/T42061-2022标准与《医疗器械生产质量管理规范》及《医疗器械生产质量管理规范现场检查指导原则》之间联系,帮助学员将法规要求落入质量体系建立、运行及完善过程中。 掌握内审的原则、基本流程和需注意的问题。 掌握内审文件的编制方法、审核的具体内容,培养具体组织实施内审的能力。 通过不符合案例分析,提升质量管理能力,丰富内审检查经验。
2、省时省力——无需长途跋涉、差旅食宿、劳神费力;
3、参与度高——全员参与,相当于全厂做了一次内训;
4、互动答疑——课程设有交流答疑环节,可连麦互动实现真实场景的互动答疑;
5、视频回放——支持1次再回放,解决企业转训复训再学习,无需另付费;
6、专题测试——课程配套线上专题测试,并在线打分,培训效果无忧;
7、培训证书——课程结束后,统一考试,考试合格者由国家认证认可监督管理委员会具备 ISO13485 管理体系的认证机构颁发的内审员证书。
中国化工企业管理协会医药化工专业委员会特聘专家
曾任医疗器械研发公司质量总监、质量负责人、体外诊断试剂生产企业管理者代表
具有14年大型制药公司质量管理经验、11年医疗器械生产企业注册、生产、质量管理经验成功组织多项二类&三类医疗器械/体外诊断试剂技术转化、注册申报工作。
1.个人素质修养
2.审核能力要求
3.专业知识储备
2.文件和记录控制
3.人力资源控制、职责分配
4.设备设施、工作环境及监视和测量设备的控制
5.销售和服务提供
6.产品实现策划和设计开发
8.特殊过程确认及关键工序验证
9.供应商管理及采购控制
10.生产与服务提供过程管理
11.产品的监视和测量过程
12.库房管理
13.测量、分析和改进
1.审核类型
2.审核计划
3.部门审核内容的分解
4.1总要求: 4.1.1-4.1.6
4.2 文件要求: 4.2.1-4.2.5
5 管理职责:5.1- 5.6
6 资源管理:6.1-6.4
7 产品实现:7.1-7.6
8 测量分析和改进:8.1-8.5
1.人员与机构
2.厂房设施
3.设备
4.文件管理
5.设计开发
6.采购
7.生产管理
8.质量控制
9.销售
10.不合格品控制
11.不良事件
1.审核记录要求
2.审核记录样例
1.纠正与预防措施记录编写
2.审核报告实例
1.注册现场核查预审核不符合报告实例讲解
2.不符合29项,关键项13项,一般项16项,其他项8项
1.人员与机构
2.厂房设施
3.设备
4.文件管理
5.设计开发
6.采购
7.生产管理
8.质量控制
9.销售
10.不合格品控制
11.不良事件
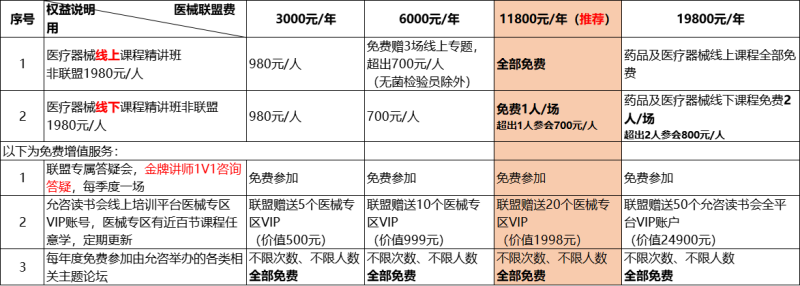
适用对象 管理层人员:企业负责人、管理者代表、质量部门负责人及各部门负责人。 管理人员:从事生产管理、质量管理、体系专员、产品质量检验人员、技术开发、人力资源、销售、采购、法规注册及各部门管理人员。 公司有计划培养为质量体系内部审核员的人员。 医疗器械监督/监管机构工作人员及其他相关人员。 线上专题精讲班-企业平价内训 参与方式: 会议费用: 1、19800 元联盟单位:制药+医械课程全部免费听课。如需证书:1500 元(包含两个证书,如需多个,另加 500 元/人) 2、11800 元医械联盟单位:免费听课,如需证书 500 元/人 3、6000元医械联盟单位:700元/人 4、3000 元医械联盟单位:980 元/人 5、非联盟 1580 元/人 6、换证:持旧证换新证超低价 联系人: 刘老师Verna:17798166030(同微信) vernaliu@yzktr.com 允咨GMP培训联盟 允咨医械培训联盟:为降低企业培训成本,加入允咨医械培训联盟,具体权益如下: 关注“允咨读书会”公众号,免费好课一键听 加入医械交流群,免费咨询行业专家




:cadyren@yzktr.com


课程咨询、赞助合作、业务合作、新媒体宣传
版权所有:石家庄允咨
联系方式:
刘老师:4008005451
特色的辅导培训 完善的教学体系 严谨的管理标准 配套的课后服务 →






